جدول مندلیف: آموزش صفر تا صد با 3 درس رایگان+ جزوه PDF

سر در آوردن یا حتی خواندن جدول تناوبی یا همان مندلیف برای اولین بار می تواند بسیار گیجکننده باشد. این جدول پر از اعداد و نماد است. وقتی تازه با آن آشنا می شوید، ممکن است برای تان بی معنا به نظر برسد. با این وجود اگر با نحوه چیدمان و ترتیب جدول تناوبی بیشتر آشنا شوید، می بینید که حاوی اطلاعات مفید زیادی در مورد عناصر است.
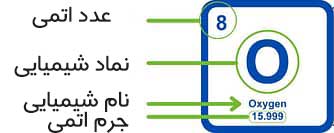
به نمودار بالا نگاه کنید. این نسخه بزرگ شده یکی از خانه یا کادر هایی است که در جدول تناوبی مشاهده می کنید. اطلاعات این کادر کمی ساده شده است. شاید ببینید که برخی از جداول تناوبی اطلاعات بسیار بیشتری به شما می دهند، اما در حال حاضر، در حد همین اطلاعات اولیه کافی است.
این نمودار جزئیات کلیدی که باید هنگام نگاه کردن به عنصری در جدول تناوبی شناسایی کنید را نشان می دهد: عدد اتمی، نماد شیمیایی، نام شیمیایی، جرم اتمی. توجه داشته باشید که جدول تناوبی بالا کمی متفاوت است و جرم اتمی در بالا و در کنار عدد اتمی نوشته شده است. نمایش جدول تناوبی در این حالت به شما کمک می کند تا عناصر مختلف را از یکدیگر جدا کنید.
یکبار برای همیشه شیمی رو قورت بده: آموزش صفر تا صد شیمی با 20 درس+ جزوه PDF
اگر دقت کنید متوجه خواهید شد که عناصر جدول تناوبی کد رنگی دارند. عناصر مختلف در گروه هایی قرار می گیرند که ویژگی های مشابهی دارند. اگر عناصری را می بینید که رنگ یکسانی دارند، به این معناست که در شرایط یکسان مثل هم عمل می کنند. به عنوان مثال، اگر عنصری در گروه فلزات قلیایی باشد، انتظار داریم که به شدت واکنش پذیر باشد و به راحتی با عناصر دیگر ترکیب شود، اما اگر در گروه گاز نجیب باشد، به راحتی با عناصر دیگر واکنش نخواهد داد.
عنصر چیست؟
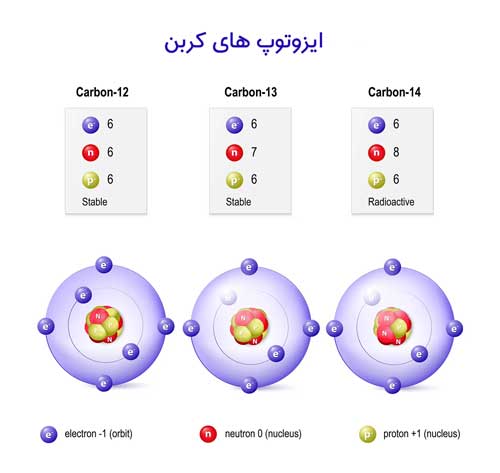
عنصر ماده خالصی است که فقط از یک نوع اتم تشکیل شده است. این بدان معناست که تمام عناصری که شبیه هم هستند اتم هایی با ساختار و ویژگی های یکسان خواهند داشت. اتم های یک عنصر تعداد پروتون یکسانی در هسته شان دارند. معمولا تعداد نوترون های اتم یک عنصر یکسان است، اما گاهی اوقات تفاوت هایی وجود دارد. اتم های یک عنصر که تعداد نوترون متفاوتی نسبت به آنچه در طبیعت رایج است، دارند، ایزوتوپ نامیده می شوند. شما این تغییرات را در جدول تناوبی نمی بینید، اما جرم اتمی که در کنار عناصر مختلف می بینید به ایزوتوپ ها اشاره دارد زیرا میانگینی از رایج ترین جرم های آن عنصر در طبیعت است.
نمیتوان عنصر هر ماده ای را با فرآیند های شیمیایی معمولی به مواد ساده تر تجزیه کرد. تقریبا 90 مورد از این عناصر به طور طبیعی در زمین وجود دارند. با این حال دانشمندان توانسته اند با استفاده از فناوری، عناصر دیگری را ایجاد کنند که به طور طبیعی وجود ندارند.
در واقع جدول های تناوبی مدرن 118 عنصر دارند. اتم های عناصر مشابه یا متفاوت با یکدیگر ترکیب می شوند و مولکول ها (گروهی از اتم ها) را در واکنش های شیمیایی به وجود می آورند. هنگامی که عناصر با هم ترکیب می شوند، مواد جدیدی مثل آب یا فولاد به وجود می آید. گاهی اوقات عناصر و مواد مختلف با هم مخلوط می شوند و چیز هایی مثل هوا یا سنگ را می سازند.
عدد اتمی
عدد اتمی یک عنصر نشان دهنده تعداد پروتون های درون اتم آن عنصر است. پروتون یک ذره با بار مثبت در مرکز اتم یا هسته آن است. پروتون ها فقط یک قسمت از هسته اتم را تشکیل می دهند. نوترون ها یا همان ذرات بدون بار هم در مرکز اتم قرار دارند. با این حال، عدد اتمی به شما در شناسایی تعداد نوترون های یک عنصر کمکی نمی کند.
عناصر پایدار خنثی خواهند بود، بنابراین ذرات با بار الکتریکی مثبت و ذرات با بار منفی باید در تعادل باشند. به همین دلیل، ما می توانیم از عدد اتمی برای شناسایی ذرات دارای بار منفی یا همان الکترون های درون اتم استفاده کنیم. اگر عنصر دارای بار 0 باشد، تعداد الکترون های آن با عدد اتمی یکسان خواهد بود.
نکته دیگری که باید بدانید این است که عدد اتمی یک عنصر هیچ وقت تغییر نخواهد کرد. چیزهای دیگری مثل تعداد نوترون ها در یک عنصر متفاوت هستند، اما تعداد پروتون های آن هیچ وقت تغییر نخواهد کرد. اگر مقدار پروتون ها را تغییر دهید، در نهایت با یک عنصر کاملا متفاوت روبرو خواهید شد!
نماد و نام شیمیایی
به همان اندازه که عدد اتمی یک عنصر مهم است، نام و نماد هایی که برای اشاره به آن استفاده می کنیم هم مهم هستند. نام هر عنصر در جدول تناوبی به همراه یک نماد کوتاه شده می آید که هنگام نوشتن فرمول های شیمیایی از آن استفاده می کنیم. یادگیری نام و نماد های این عناصر به همراه موقعیت تقریبی آن ها در جدول برای این که بتوانید به راحتی پیدای شان کنید، بسیار مهم است.
برخی از رایج ترین عناصری که در مورد آن ها صحبت خواهید کرد عبارتند از: هیدروژن (H)، هلیوم (He)، سدیم (Na)، آهن (Fe)،کربن (C)، نیتروژن (N)، اکسیژن (O) و کلر (Cl). شما روزانه با بسیاری از این عناصر در تماس هستید، بنابراین بهانه بسیار خوبی برای آشنا شدن با این عناصر و واکنش های شیمیایی دارید.
شاید هنگام خواندن جدول مندلیف متوجه شده باشید که برخی از نماد های عناصر دقیقا با نام شان مطابقت ندارند. علت این است که نماد های برخی از عناصر بر اساس نام لاتین شان که در زمان های قدیم شناخته شده بودند، ایجاد شده اند. به عنوان مثال آهن با نماد Fe نمایش داده می شود زیرا نام لاتین آن ferrum بوده است.
جرم اتمی
جرم اتمی با عدد پایین خانه هر عنصر در جدول تناوبی نشان داده می شود. این عدد جرم کل یک اتم از یک عنصر را بر حسب واحد جرم اتمی یا AMU نشان می دهد. همان طور که در بالا اشاره شد، هسته یک اتم از پروتون و نوترون تشکیل شده است. واحد جرم اتمی هر یک از این ذرات، 1 است. اگر یک اتم دارای 5 پروتون و 5 نوترون باشد ، کل AMU آن 10 خواهد بود.
حالا ممکن است از خودتان بپرسید تکلیف الکترون ها چه می شود؟ واقعیت اینست که آن ها در اتم ها هستند، اما در مقایسه با پروتون یا نوترون آن قدر کوچک هستند که جرم شان در محاسبات قابل توجه نیست. به همین دلیل، جرم اتمی برای تشخیص تعداد الکترون های درون یک اتم به کار نمی آید و باید به سراغ عدد اتمی بروید.
جرم اتمی برای شناسایی تعداد نوترون های درون یک اتم مناسب است. از آن جایی که جرم اتمی با توجه به پروتون ها و نوترون های درون یک اتم محاسبه می شود، می توانید تعداد نوترون های درون یک اتم را با کم کردن عدد اتمی (پروتون ها) از جرم اتمی (پروتون ها و نوترون ها) محاسبه کنید.
قبلا هم اشاره کردیم که همه اتم های یک عنصر باید تعداد پروتون های یکسانی داشته باشند. البته این در مورد نوترون ها صادق نیست! تعداد پروتون ها و نوترون های یک اتم همیشه با هم برابر نیست، بنابراین گاهی اوقات تشخیص این تفاوت ها لازم است.
اگر به برخی از جدول های تناوبی دقت کنید، متوجه می شوید که جرم اتمی به صورت اعشاری درج شده است. چرا با این که نمی توان بخشی از یک پروتون یا نوترون را محاسبه کرد، این عدد اعشاری است؟ به این دلیل است که این اعداد بر اساس میانگین رایج ترین نوع عنصر موجود در طبیعت است. همه عناصر گونه های مختلف و تعداد نوترون های (کمی) متفاوتی دارند. به این گونه ها ایزوتوپ می گویند. این ایزوتوپ ها از نظر شیمیایی یکسان عمل می کنند اما ممکن است خواص فیزیکی متفاوتی داشته باشند. برخی از این ایزوتوپ ها حتی ممکن است رادیو اکتیو باشند.
بار الکتریکی
بیشتر اتم ها معمولا دارای بار الکتریکی خنثی هستند، اما هنگامی که الکترون به دست می آورند یا از دست می دهند، بارشان منفی یا مثبت می شود. جدول تناوبی به شما کمک می کند تا میزان باری که یک عنصر معمولا در واکنش های شیمیایی دارد را تعیین کنید.
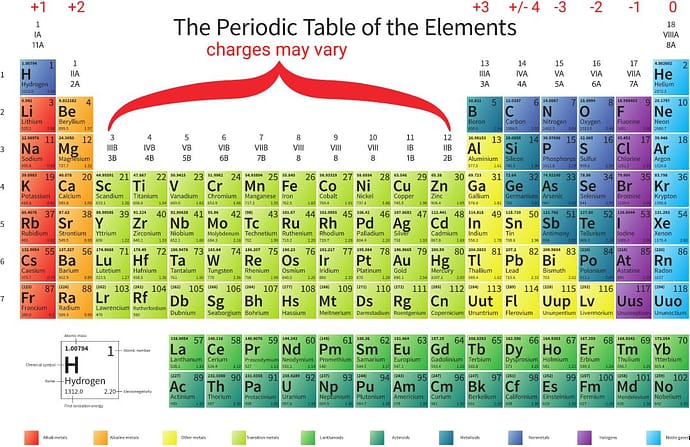
از گروه 1 شروع می کنیم و می بینیم که عناصر دارای بار مثبت هستند. برای تعیین میزان بار الکتریکی به آخرین رقم عدد نگاه کنید. گروه 1 دارای بار الکترویکی 1+ و گروه 2 دارای بار 2+ است. از فلزات واسطه (گروه های 3 تا 12) صرف نظر کنید زیرا عناصر موجود در آن منطقه ممکن است بار الکتریکی مختلفی داشته باشند.
گروه 13 دارای بار الکتریکی +3 و گروه 14 ممکن است بار + یا 4- داشته باشد . درگروه 15، بار الکتریکی منفی است و با بار 3- شروع می شود. بار در گروه 18 به 0 می رسد.
بلد باشید: آموزش تایپ ریاضی در ورد (و 5 نکته)
این اطلاعات زمانی اهمیت پیدا می کند که بخواهید این عناصر را برای تشکیل پیوند های یونی با هم ترکیب کنید. این پیوند ها زمانی ایجاد می شوند که اتم ها یا یون های باردار جذب یکدیگر شده و با هم ترکیب شوند. آسان ترین روش برای فهمیدن این که چگونه دو یون با هم ترکیب می شوند، اختصاص بار به عنصر مخالف است.
از هر عنصر باید به تعداد بار عنصر مخالف وجود داشته باشد تا ترکیب حاصل خنثی شود . در مثال زیر، Be دارای بار 2+ و Cl دارای بار 1- است. این یعنی برای ترکیب ، به 2 اتم کلر نیاز دارید تا بار 2+ عنصر Be را متعادل کنید. ترکیب حاصل Be خواهد شد.
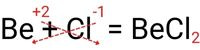
گروه

انحراف معیار: آموزش صفر تا صد رایگان+ جزوه pdf
هر گروه در جدول تناوبی شامل اتم هایی است که به صورت عمودی در ستون های جدول تناوبی پشت سر هم قرار گرفته اند. عناصر درون یک گروه دارای ویژگی های فیزیکی یا شیمیایی مشابهی هستند زیرا لایه های الکترونی بیرونی آن ها مشابه هستند. اما شباهت های دیگری هم وجود دارد. مثلا مواد حاوی عناصر گروه 2، که در تصویر بالا نشان داده شده اند، وقتی بریده می شوند، درخشش خاکستری رنگی دارند که مایل به سفید است، اما وقتی در معرض هوا قرار می گیرند، به سرعت کدر می شوند. این عناصر رسانای خوبی برای الکتریسیته هستند و نقطه ذوب و جوش بالاتری نسبت به فلزات قلیایی در گروه 1 دارند. در مقابل عناصر گروه 17 به شدت واکنش پذیر هستند طوری که به تنهایی در طبیعت یافت نمی شوند. آن ها نسبتا سمی هم هستند و وقتی با هیدروژن ترکیب می شوند، تشکیل اسید می دهند. این عناصر وقتی به شکل خالص هستند، به صورت مولکول های دو اتمی وجود دارند. گروه اتم ها در جدول تناوبی نام و کد رنگ خاص خودشان را دارند که نشان می دهد ویژگی های مشابهی دارند.
دوره
دوره به ردیفی از عناصر شیمیایی در جدول تناوبی اشاره دارد. عناصر موجود در یک ردیف تعداد لایه های الکترونی یکسانی دارند. هر عنصر یک ردیف، یک پروتون بیشتر از اتم های قبلیاش دارد و خاصیت فلزی اش نسبت به عنصر سمت چپ کم تر است.
![]()
آموزش ویدیویی جدول مندلیف (و نمونه تست ها)
جزوه PDF خلاصه و جمع بندی جدول مندلیف
کلام آخر
جدول تناوبی ابزار خوبی است و می تواند اطلاعات زیادی در مورد عناصر و خواص شیمیایی آن ها به صورت اجمالی در اختیارتان قرار دهد. برخی از جداول تناوبی ممکن است پیشرفته تر از بقیه باشند، اما حتی به محض یادگیری نحوه خواندن ساده ترین جدول های تناوبی هم چیز های زیادی در مورد یک عنصر و ویژگی های آن خواهید فهمید. جدول تناوبی برای درک بهتر مفاهیم شیمی، واکنش ها و خواص عناصر واقعا کمک کننده و لازم است.








مطالب عالی و روان بود و مطالب بسادگی تفهیم شد.
پاسخ