قانون دوره ای عناصر از 0 تا 100 برای شیمی دهم و یازدهم+ PDF
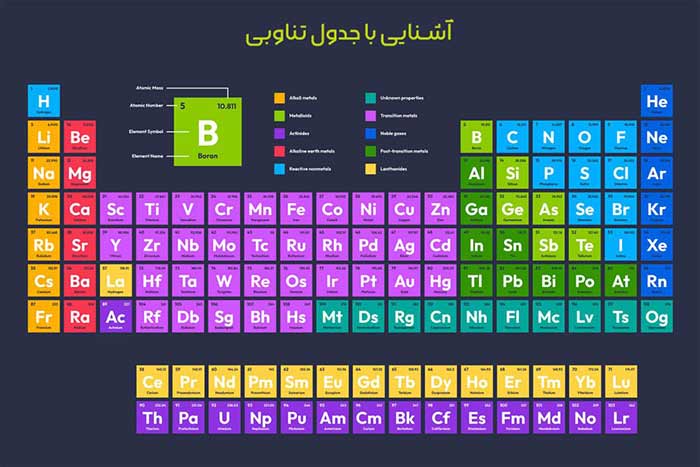
جدول دورهای عناصر، یکی از مهمترین ابزارهای علمی در شیمی است که بهعنوان نقشهای برای درک ویژگیهای شیمیایی و فیزیکی عناصر عمل میکند. این جدول، که ابتدا توسط دیمیتری مندلیف در سال 1869 طراحی شد، عناصر شیمیایی را بر اساس خواص مشترک و عدد اتمی آنها سازماندهی میکند. اما چرا این جدول اینقدر مهم است؟
چگونه میتوان از آن بهصورت کاربردی استفاده کرد؟ این مقاله بهگونهای نوشته شده که هم برای مبتدیان قابل فهم باشد و هم اطلاعات جامعی برای علاقهمندان به شیمی ارائه دهد. با نگاهی منسجم و ساختارمند، به تاریخچه، ساختار، کاربردها، و نکات کلیدی قانون دورهای میپردازیم تا هیچ سوالی بیپاسخ نماند.
تاریخچه قانون دورهای
داستان جدول دورهای با تلاشهای دانشمندانی آغاز شد که سعی داشتند نظمی در میان عناصر شیمیایی کشف کنند. در اوایل قرن نوزدهم، دانشمندان مانند یوهان ولفگانگ دوبراینر و جان نیولندز ایدههایی درباره گروهبندی عناصر بر اساس خواص مشابه ارائه کردند. دوبراینر مفهوم "تریادها" را معرفی کرد، که در آن سه عنصر با خواص مشابه را در یک گروه قرار میداد. نیولندز نیز قانون اکتاوها را پیشنهاد کرد، که شباهتهایی بین عناصر را در بازههای هشتتایی نشان میداد.
اما نقطه عطف واقعی با کار دیمیتری مندلیف رقم خورد. مندلیف در سال 1869 جدولی طراحی کرد که عناصر را بر اساس افزایش وزن اتمی و خواص شیمیایی مشابه مرتب کرد. او نهتنها عناصر شناختهشده را سازماندهی کرد، بلکه با پیشبینی وجود عناصر کشفنشده (مانند گالیوم و ژرمانیوم) و جای خالی گذاشتن برای آنها، جدول خود را به یک ابزار پیشبینیکننده تبدیل کرد. این پیشبینیها بعدها با کشف این عناصر تأیید شدند و اعتبار جدول مندلیف را بالا بردند.
بلد باشید: آموزش اینترنت از صفر تا صد با نکات و ترفندها+ جزوه PDF
امروزه، جدول دورهای بر اساس عدد اتمی (تعداد پروتونها در هسته اتم) مرتب شده است، که این تغییر پس از کشف ساختار اتمی توسط هنری موزلی در سال 1913 اعمال شد. این جدول اکنون شامل 118 عنصر شناختهشده است و همچنان بهعنوان پایهای برای مطالعات شیمیایی و حتی فیزیک و زیستشناسی عمل میکند.
ساختار جدول دورهای
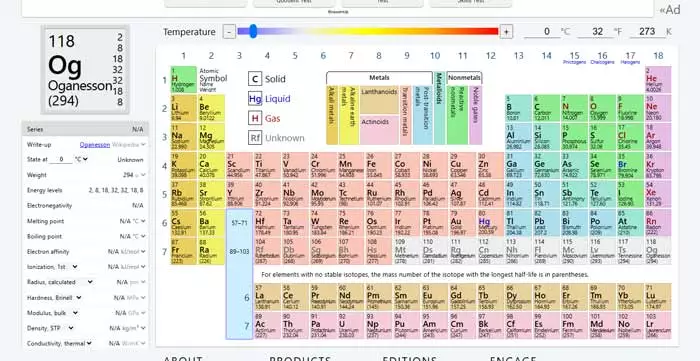
جدول دورهای بهگونهای طراحی شده که اطلاعات زیادی را در قالبی ساده ارائه میدهد. برای درک بهتر، ساختار آن را بهصورت زیر بررسی میکنیم:
- دورهها (Periods) : ردیفهای افقی جدول، دوره نامیده میشوند. هر دوره نشاندهنده تعداد لایههای الکترونی در اتمهای عناصر است. برای مثال، دوره اول شامل عناصری با یک لایه الکترونی (هیدروژن و هلیوم) است، در حالی که دوره دوم عناصری با دو لایه الکترونی دارد.
- گروهها (Groups) : ستونهای عمودی جدول، گروه نامیده میشوند. عناصر یک گروه خواص شیمیایی مشابهی دارند، زیرا تعداد الکترونهای لایه خارجی (والانس) آنها یکسان است. برای مثال، گروه 1 (فلزات قلیایی) شامل عناصری بسیار واکنشپذیر مانند لیتیم و سدیم است.
- بلوکها: جدول دورهای به چهار بلوک s، p ، d و f تقسیم میشود که بر اساس نوع اوربیتالهایی که الکترونهای والانس در آنها قرار دارند، نامگذاری شدهاند. این بلوکها به درک رفتار شیمیایی عناصر کمک میکنند.
جدول همچنین شامل دستهبندیهایی مانند فلزات، نافلزات، و شبهفلزات است. فلزات (مانند آهن و مس) معمولاً براق، رسانا و شکلپذیر هستند، در حالی که نافلزات (مانند اکسیژن و گوگرد) خواص متفاوتی دارند و اغلب عایق هستند. شبهفلزات (مانند سیلیکون) خواصی بین فلزات و نافلزات دارند و در صنایع نیمههادی بسیار مهماند.
ویژگیهای کلیدی عناصر در جدول دورهای
هر خانه در جدول دورهای اطلاعات خاصی درباره یک عنصر ارائه میدهد:
- عدد اتمی: تعداد پروتونها در هسته، که هویت عنصر را تعیین میکند.
- جرم اتمی: میانگین وزن ایزوتوپهای یک عنصر، که معمولاً به واحد جرم اتمی (amu) بیان میشود.
- نماد شیمیایی: نشانهای کوتاه برای هر عنصر (مثلاً Fe برای آهن).
- الکترونگاتیویته: توانایی اتم برای جذب الکترون در پیوند شیمیایی.
- شعاع اتمی: اندازه اتم، که در یک دوره از چپ به راست کاهش مییابد و در یک گروه از بالا به پایین افزایش مییابد.
قانون دورهای چیست؟
قانون دورهای بیان میکند که خواص شیمیایی و فیزیکی عناصر بهصورت دورهای با افزایش عدد اتمی تغییر میکنند. این قانون به ما میگوید که وقتی عناصر بر اساس عدد اتمی مرتب شوند، الگوهای تکرارشوندهای در ویژگیهایی مانند واکنشپذیری، شعاع اتمی و الکترونگاتیویته مشاهده میشود. این الگوها به دلیل ترتیب الکترونها در لایههای انرژی اتمها به وجود میآیند.
برای مثال، فلزات قلیایی (گروه 1) بسیار واکنشپذیرند، زیرا یک الکترون در لایه خارجی خود دارند که بهراحتی از دست میدهند. در مقابل، گازهای نجیب (گروه 18) بسیار پایدارند، زیرا لایه خارجی آنها کاملاً پر است.
مهارتی که واسه کنکوری ها فوق العاده مهمه! آموزش خلاصه نویسی و نکته برداری صفر تا صد+ نکات و ترفندها
خواص فیزیکی عناصر جدول تناوبی
خواص فیزیکی عناصر به ویژگیهایی اشاره دارند که بدون تغییر ماهیت شیمیایی عنصر قابل مشاهده یا اندازهگیری هستند. این خواص شامل حالت فیزیکی (جامد، مایع، گاز)، نقطه ذوب و جوش، چگالی، رنگ، و رسانایی است. برای مثال، هیدروژن و هلیوم در دمای اتاق گاز هستند، در حالی که جیوه و برم تنها عناصریاند که بهصورت مایع وجود دارند. فلزاتی مانند مس و آلومینیوم رسانای خوب الکتریسیته و گرما هستند، در حالی که نافلزاتی مانند گوگرد عایقاند. خواص فیزیکی در جدول تناوبی الگوهای مشخصی دارند:
- در یک دوره (ردیف افقی)، از چپ به راست، عناصر از فلزی به نافلزی تغییر میکنند و چگالی معمولاً افزایش مییابد.
- در یک گروه (ستون عمودی)، از بالا به پایین، نقطه ذوب و جوش فلزات کاهش مییابد، اما شعاع اتمی افزایش مییابد. این ویژگیها در کاربردهای صنعتی، مانند انتخاب سیلیکون برای نیمههادیها یا تنگستن برای لامپهای رشتهای به دلیل نقطه ذوب بالای آن، نقش کلیدی دارند.
خواص شیمیایی عناصر جدول تناوبی
خواص شیمیایی عناصر به رفتار آنها در واکنشهای شیمیایی و توانایی تشکیل پیوند با دیگر عناصر مربوط میشود. این خواص به تعداد الکترونهای لایه والانس (لایه خارجی) بستگی دارند. برای مثال، فلزات قلیایی (گروه 1، مانند سدیم و پتاسیم) به شدت واکنشپذیرند، زیرا یک الکترون در لایه خارجی دارند که بهراحتی از دست میدهند و یونهای مثبت تشکیل میدهند.
در مقابل، گازهای نجیب (گروه 18، مانند نئون و آرگون) به دلیل پر بودن لایه والانس خود بسیار پایدار و غیرفعالاند. هالوژنها (گروه 17، مانند فلوئور و کلر) به شدت الکترونگیر هستند و با فلزات ترکیبات یونی مانند نمک (کلرید سدیم) تشکیل میدهند. الکترونگاتیویته، که توانایی جذب الکترون در پیوند است، از چپ به راست در یک دوره افزایش مییابد، در حالی که واکنشپذیری فلزات در یک گروه از بالا به پایین بیشتر میشود. این خواص شیمیایی در طراحی مواد جدید، داروسازی (مانند استفاده از پلاتین در شیمیدرمانی) و حتی در فرآیندهای زیستی (مانند نقش فسفر در DNA) حیاتیاند.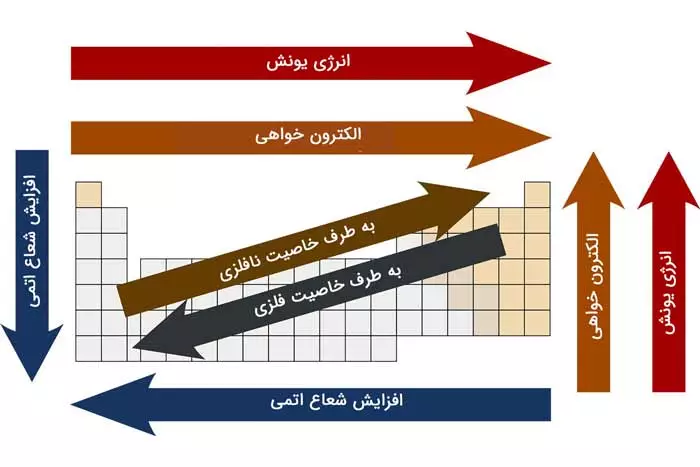
بلد باشید: آموزش صفر تا صد زبان انگلیسی+ جزوه PDf
کاربردهای جدول دورهای
جدول دورهای نهتنها در کلاسهای شیمی، بلکه در بسیاری از زمینههای علمی و صنعتی کاربرد دارد. در ادامه به برخی از این کاربردها اشاره میکنیم:
- شیمی: پیشبینی واکنشهای شیمیایی و طراحی ترکیبات جدید.
- فیزیک: مطالعه خواص اتمی و هستهای عناصر.
- زیستشناسی: درک نقش عناصر (مانند کلسیم در استخوانها یا آهن در هموگلوبین) در فرآیندهای زیستی.
- صنعت: استفاده از عناصر خاص در فناوری، مانند سیلیکون در تراشههای کامپیوتری یا لیتیوم در باتریها.
- پزشکی: کاربرد عناصری مانند ید در تصویربرداری پزشکی یا پلاتین در داروهای شیمیدرمانی.
چگونه از جدول دورهای استفاده کنیم؟
برای مبتدیان، استفاده از جدول دورهای ممکن است پیچیده به نظر برسد، اما با چند مرحله ساده میتوانید بهراحتی از آن بهره ببرید:
- یافتن عنصر: ابتدا نماد شیمیایی عنصر را در جدول پیدا کنید (مثلاً O برای اکسیژن).
- بررسی عدد اتمی و جرم: این اطلاعات در هر خانه نمایش داده شدهاند و به شما کمک میکنند تا هویت و وزن عنصر را بشناسید.
- درک گروه و دوره: گروه عنصر نشاندهنده خواص شیمیایی آن است، و دوره نشان میدهد که اتم چند لایه الکترونی دارد.
- مقایسه خواص: از جدول برای مقایسه ویژگیهایی مانند الکترونگاتیویته یا شعاع اتمی بین عناصر استفاده کنید.
ویدیوی آموزشی
با کمک ویدیوی زیر در حدود 20 دقیقه مفاهیم و اصول جدول دوره ای رو یاد می گیرید و برای یادگیری کامل پایین تر جزوه PDF رو دانلود کنید:
نکات کلیدی برای یادگیری جدول دورهای
برای یادگیری بهتر جدول دورهای، این نکات را در نظر بگیرید:
- گروههای مهم را یاد بگیرید: فلزات قلیایی (گروه 1)، فلزات قلیایی خاکی (گروه 2)، هالوژنها (گروه 17) و گازهای نجیب (گروه 18) را به خاطر بسپارید.
- الگوها را شناسایی کنید: به تغییرات خواص در دورهها و گروهها توجه کنید. برای مثال، واکنشپذیری فلزات در گروه 1 از بالا به پایین افزایش مییابد.
- از ابزارهای بصری استفاده کنید: اپلیکیشنها و جدولهای دورهای تعاملی (مانند Ptable.com) میتوانند یادگیری را جذابتر کنند.
- تمرین کنید: سعی کنید عناصر رایج و ویژگیهای آنها را حفظ کنید یا واکنشهای شیمیایی ساده را پیشبینی کنید.
چالشها و پیشرفتهای اخیر
در سالهای اخیر، دانشمندان عناصر مصنوعی جدیدی مانند تنسین (Ts) و اوگانسون (Og) را به جدول اضافه کردهاند. این عناصر که در آزمایشگاهها ساخته میشوند، بسیار ناپایدارند و تنها برای کسری از ثانیه وجود دارند. این پیشرفتها نشاندهنده پویایی علم شیمی و تکامل مداوم جدول دورهای است.
علاوه بر این، فناوریهای جدید مانند هوش مصنوعی و شبیهسازیهای کامپیوتری به دانشمندان کمک میکنند تا خواص عناصر را با دقت بیشتری پیشبینی کنند. برای مثال، ابزارهای محاسباتی میتوانند رفتار عناصر در شرایط خاص (مانند فشار یا دمای بالا) را مدلسازی کنند.
بلد باشید: آموزش تصویری تندخوانی 0 تا 100 و تکنیکها+ PDF رایگان

نکات کاربردی برای استفاده روزمره
حتی اگر شیمیدان نیستید، جدول دورهای میتواند در زندگی روزمره مفید باشد:
- انتخاب مواد ایمن: دانستن خواص عناصر (مانند سمی بودن سرب یا پایداری هلیوم) به شما کمک میکند تصمیمات آگاهانهتری بگیرید.
- درک محصولات روزمره: از عناصر موجود در باتریها (لیتیوم) تا جواهرات (طلا و نقره)، جدول دورهای به شما اطلاعات مفیدی درباره مواد اطرافتان میدهد.
- آموزش کودکان: جدول دورهای میتواند راهی سرگرمکننده برای آموزش علوم به کودکان باشد، بهویژه با استفاده از بازیها و اپلیکیشنهای تعاملی.
بلد باشید: جدول تناوبی با شعاع اتمی از 0 تا 100 نکات (بالا به پایین و چپ به راست)
پاسخ به سوالات رایج
- چرا جدول دورهای اینقدر مهم است؟
- جدول دورهای به دانشمندان و دانشجویان کمک میکند تا خواص عناصر را درک کنند، واکنشهای شیمیایی را پیشبینی کنند و مواد جدید طراحی کنند. این جدول مانند یک زبان مشترک برای علوم است.
- چرا برخی عناصر کشفنشده در جدول پیشبینی شدند؟
- مندلیف متوجه الگوهای دورهای شد و برای حفظ نظم جدول، جای خالی برای عناصری گذاشت که هنوز کشف نشده بودند. این پیشبینیها بر اساس خواص مشابه عناصر دیگر بود.
- آیا جدول دورهای تغییر میکند؟
- بله، با کشف عناصر جدید (مانند عناصر مصنوعی سنگین مثل اوگانسون)، جدول بهروزرسانی میشود. با این حال، ساختار اصلی آن ثابت است.
- چگونه میتوان جدول را به خاطر سپرد؟
- استفاده از تکنیکهای حفظی مانند آهنگها، کارتهای فلش، یا گروهبندی عناصر بر اساس خواص مشابه میتواند کمککننده باشد. همچنین، تمرکز بر عناصر پرکاربرد (مانند کربن، اکسیژن و نیتروژن) نقطه شروع خوبی است.
حجم: 2 مگابایت
سطح: از صفر تا صد
نتیجهگیری
جدول دورهای عناصر، یکی از شاهکارهای علمی است که نهتنها نظم دنیای شیمی را نشان میدهد، بلکه ابزاری قدرتمند برای پیشبینی و نوآوری است. این جدول با ساختار منظم و اطلاعات دقیق خود، به همه، از دانشآموزان مبتدی تا دانشمندان حرفهای، کمک میکند تا دنیای عناصر را بهتر درک کنند. با یادگیری اصول اولیه، شناخت گروهها و دورهها، و استفاده از ابزارهای آموزشی، هر کسی میتواند از این جدول بهره ببرد. چه بخواهید واکنشهای شیمیایی را پیشبینی کنید، چه در مورد مواد اطرافتان بیشتر بدانید، جدول دورهای راهنمای شماست. حالا وقت آن است که این جدول را کاوش کنید و از شگفتیهای علم شیمی لذت ببرید!